摘要:点击下方蓝色字体了解七月份培训内容!! 8月21日杭州-2020申报受理最新要求及合规的资料撰写实战 9月4日上海-第二期“2020研发及QC实验室合规管理专题培 9月11日苏州-2020药品数据管理规范实施研讨 9月25日济南-如何应对并高效处理实验室OOS的发生专题培训 8
|
点击下方蓝色字体了解七月份培训内容!! 8月21日杭州-2020申报受理最新要求及合规的资料撰写实战 9月4日上海-第二期“2020研发及QC实验室合规管理专题培 9月11日苏州-2020药品数据管理规范实施研讨 9月25日济南-如何应对并高效处理实验室OOS的发生专题培训 8月27日成都-第二期“药品研发质量管理体系建立、实施、维护和提升中面临的困扰与对策” 参加培训可获价值499元药成材线上培训年度会员,咨询及商务合作请联系:孙彬-13120221304兼微信。
9月11日杭州-统计技术及其在GMP实施中应用实操培训 8月20日南京-2020版药典企业实施应用专题研讨班 8月12日上海-美国FDA和欧盟GMP质量体系与现场GMP检查趋势分析和缺陷及回复方式详解培 9月9日杭州-第二期“2020多类型企业MAH综合管控体系建设实战培 8月21日南京-2020 MAH制度全面实施及企业应对策略 9月3日上海2020全球药典制药用水法规动态与全生命周期质量 8月21日上海-医药、化工连续化自动化安全化工艺设计高级培训
转自:药研之家 2020研发及QC实验室合规管理专题培训 各有关单位: 2020年突如其来的疫情,给国内外制药行业带来了巨大的影响。另一方面,药发布的一系列文件,包括新药法,新注册管理办法,以及生产监督管理办法等,也给我们制药企业的日常合格管理带来了更大的压力。 一直以来,制药企业的研发及GMPQC实验室都是经常出现问题的版块,尤其是FDA 的483观察项,越来越多的实验室管理问题。日常运营、数据完整、检验仪器设备验证,或是人员的合规操作,都是同实验室质量体系管理密不可分的,一个良好的质量管理体系,能够保证实验室的运行的过程中合规、合法,产生出合格的放行或申报数据。 但是,空洞的法规条文,如何落地在实验室日常运营SMP及SOP中,这仍然是大家关心及最疑惑的问题。如果能够以实践为基础,将最新的法规条文运用于研发及cGMP QC实验室质量体系中,并同现场核查有机结合,最终给出完整解决方案,对于各药企,无论是提升效率、满足法规符合性,或是节约日常运营成本,都会带来非常大的帮助。这些内容,无论对于质量管理人员、质量控制人员、验证管理人员等都是十分感兴趣或急需的。 为此,本单位定于2020年9月 4日至6日在上海市举办第二期“2020研发及QC实验室合规管理专题培训班”,邀请业内权威专家针对相关问题进行深入解析。培训通知如下: 一、会议安排 会议地点:上海市(具体地点通知给已报名人员) 会议时间:2020年 9月4日- 9月 6日( 4日全天报到)
二、会议主要研讨内容及主讲老师 内容详见附件一(课程安排表)
三、参会对象 研发及制药公司的研发、QA、QC等相关部门人员。
四、会议说明 1、理论讲解,实例分析,专题讲授,互动答疑 2、主讲嘉宾均为行业内资深专家,欢迎来电咨询 3、完成全部培训课程者由协会颁发培训证书
五、会议费用 1.会务费:2500元/人(会务费包括:培训、研讨、资料、茶歇等);食宿统一安排,费用自理。 2.参加培训的学员将获得价值499元药成材线上培训平台(https://appnv8mypmx8987.h5.xiaoeknow.com/homepage)年度会员,近两百节系统课程免费学习。 六、药成材专业医药直播培训 1、药成材VIP会员一年499元 /年,团购价360元 /年 2、企业VIP团购招募中,8000元 /年 3、课程详情及办理事宜咨询会务组联系人
七、联系方式 联联系人:孙 彬 Q Q:525182570 手 机:13120221304 邮 箱:13120221304@163.com 附件一:会议日程安排 附件二:参会报名表
二零二零年七月 附件一:日 程 安 排 表
附件二:第二期2020研发及QC实验室合规管理专题培训班--回执表 因参会名额有限请尽快报名
点击下方蓝色字体可以了解近期培训内容 更新!八月份各部门制药大咖精讲汇总 点击下方“阅读原文”可以在线直接填表报名! 注:将文章转发至“朋友圈”或分享至“药学相关微信群”,加微信13120221304并发截图,可选择索取本编辑现有部分医药技术课件。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



















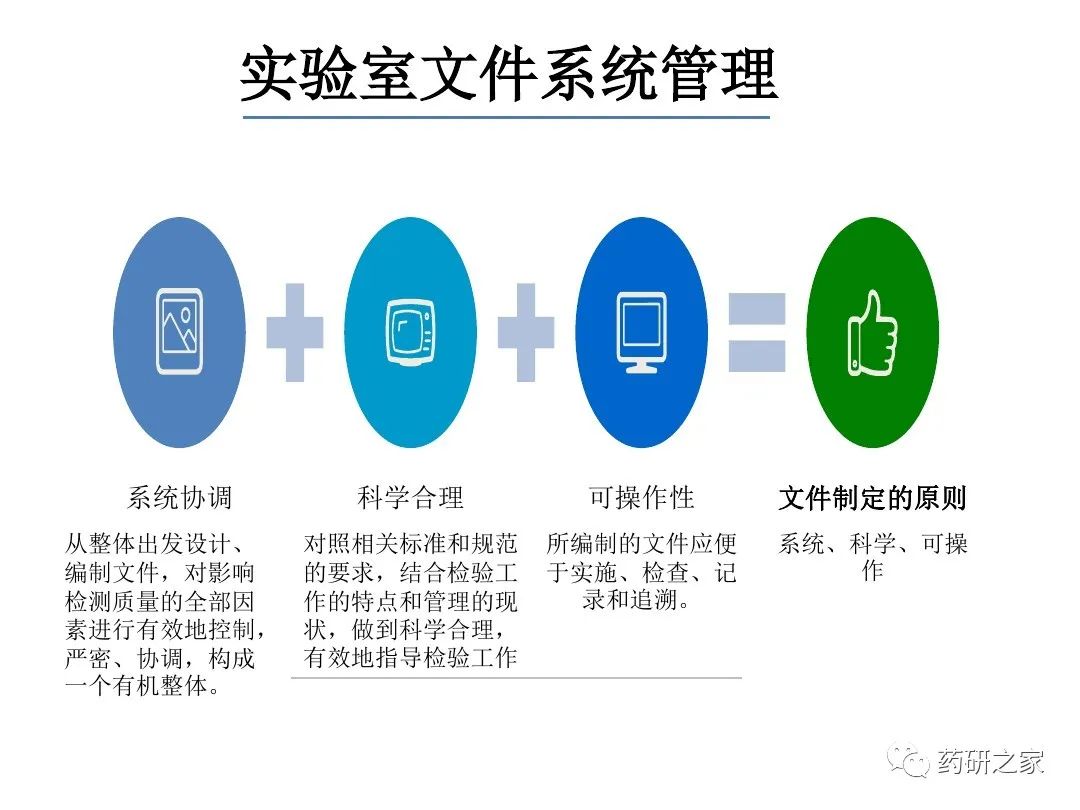
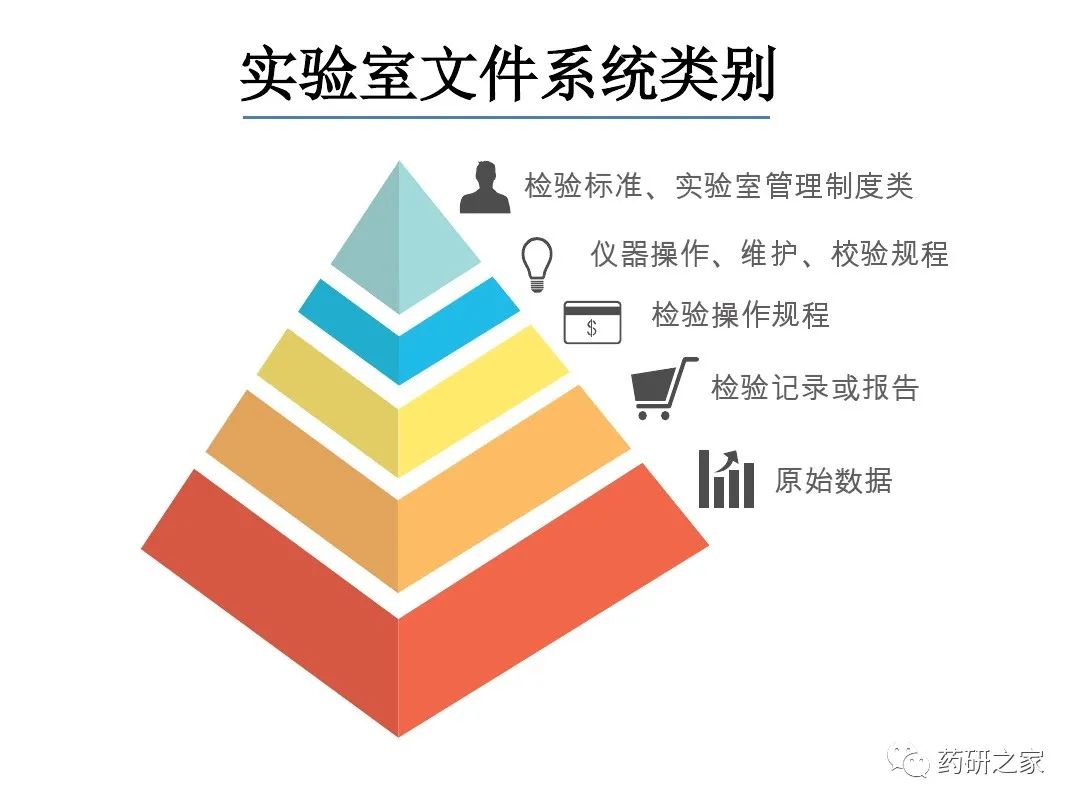


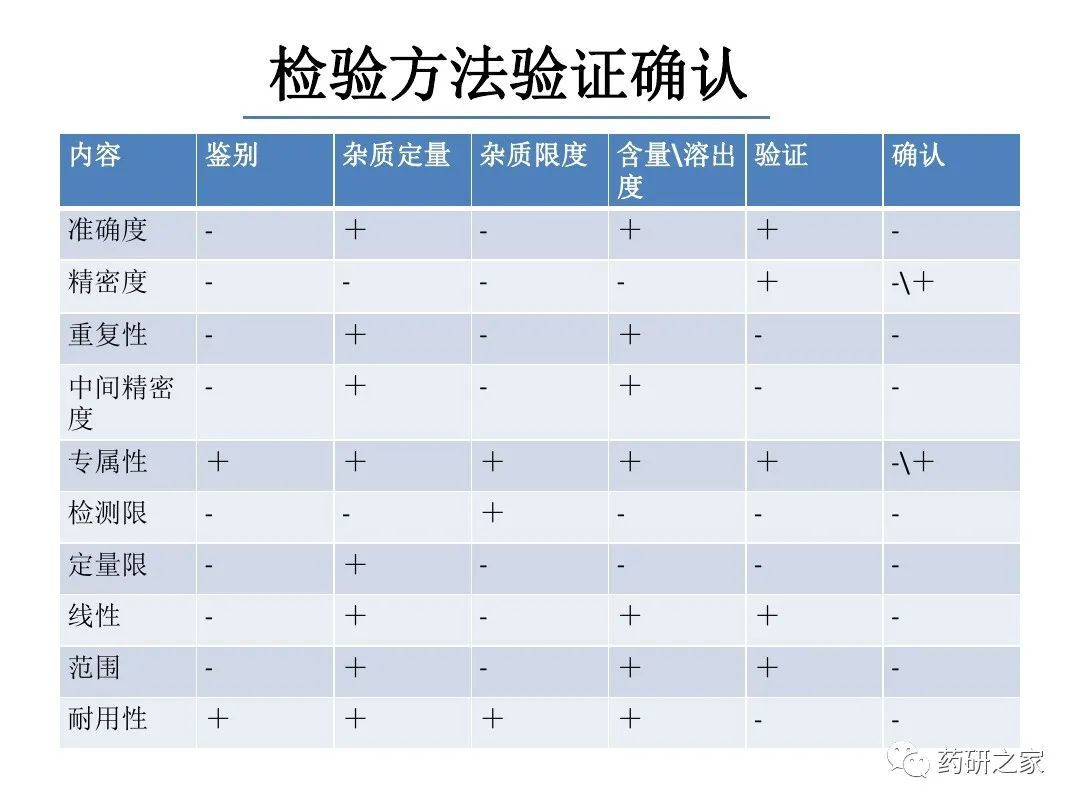






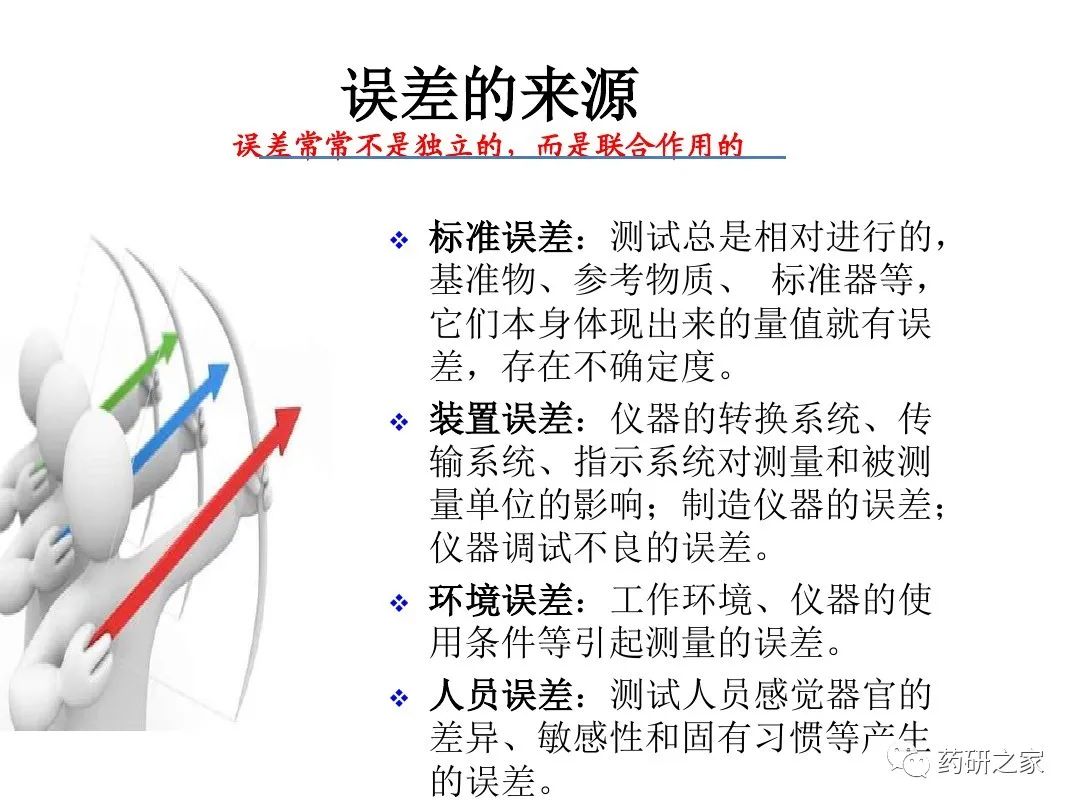

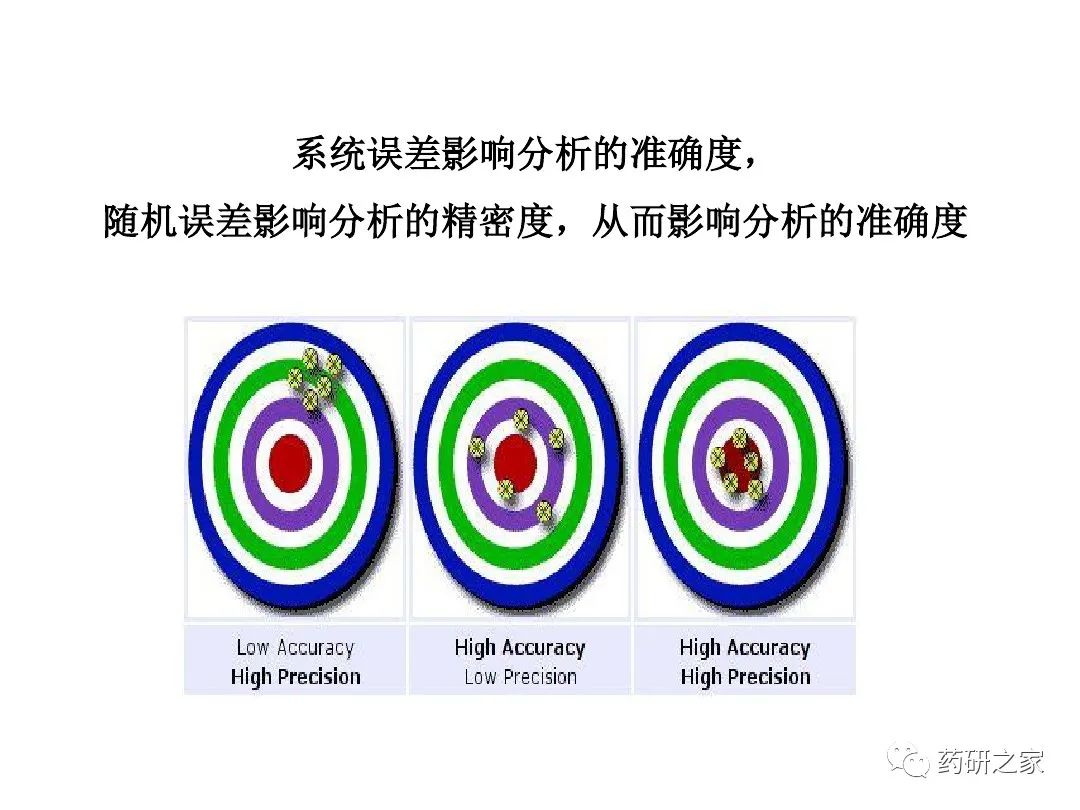

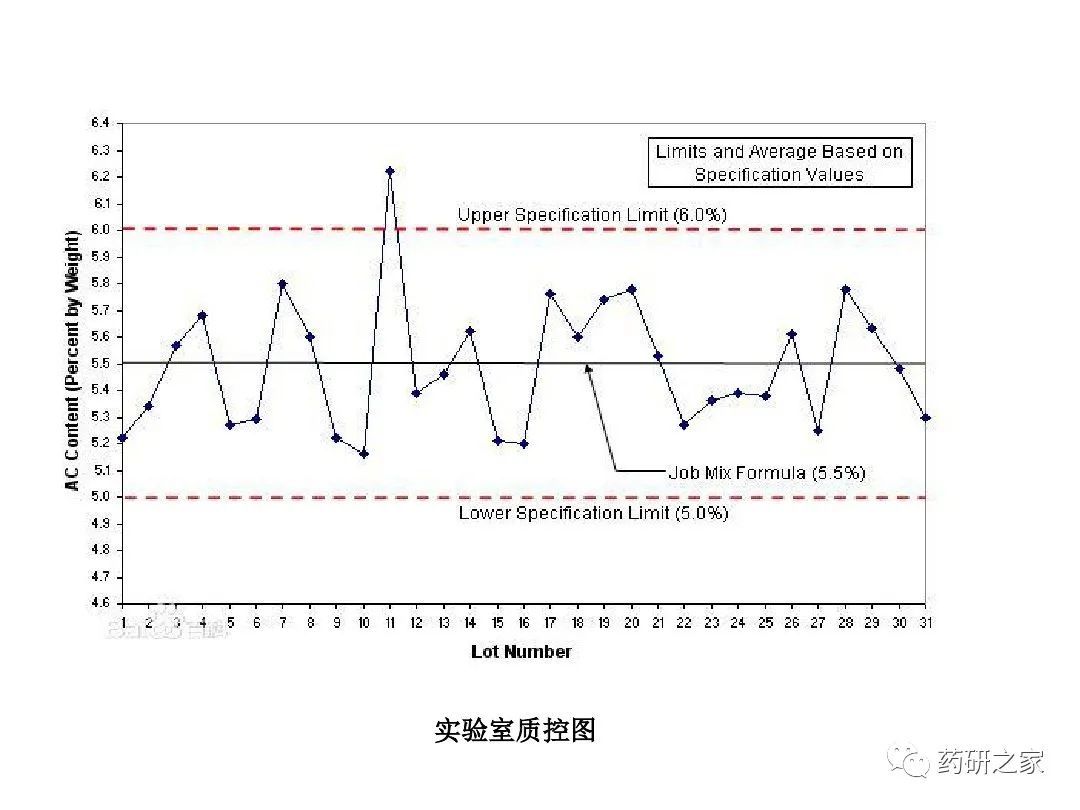

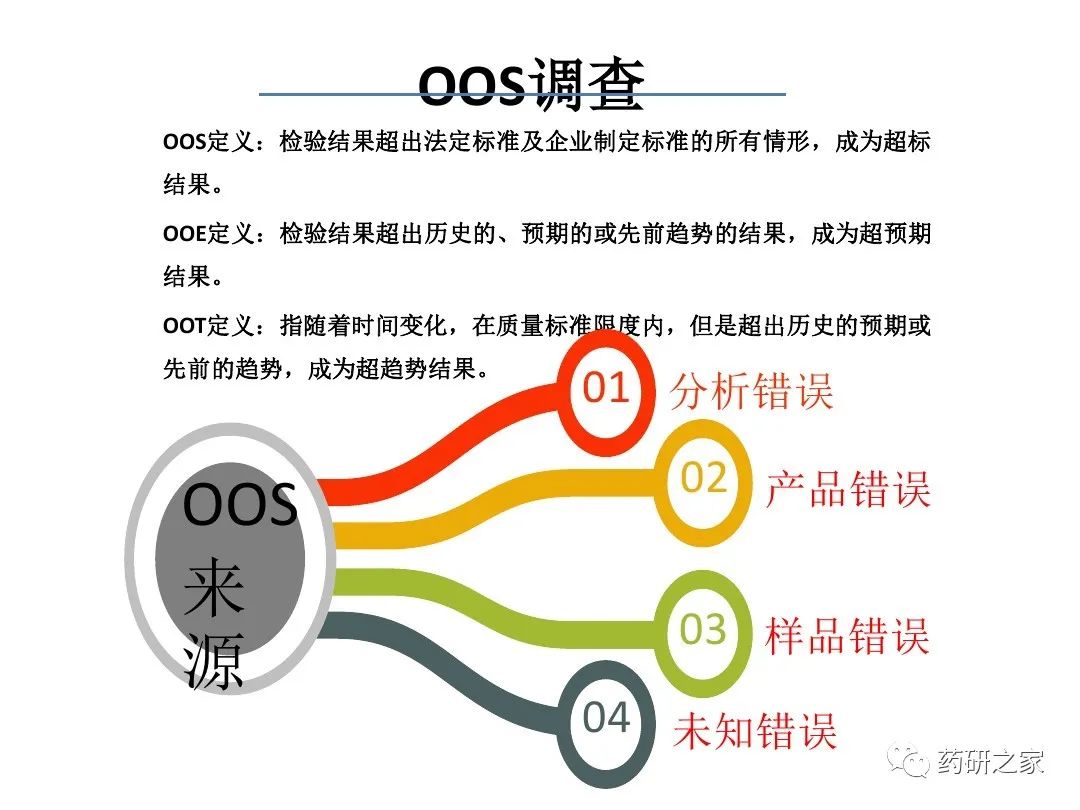



谈谈您对该文章的看